近日,福州大学贾力教授团队在Nature Communications杂志上发表文章,报道了用适体功能化的纳米颗粒消除血液中致癌性外泌体进入小肠的创新方法。

血液中的物质通常通过两种途径从全身循环中清除:通过肾脏过滤排泄到尿液中,以及通过Oddi’s括约肌的肝胆清除到小肠。小于6纳米的物质通常通过肾小球经肾脏过滤消除。没有立即被肝Kupffer细胞捕获的较大的物质通常通过肝胆清除进入小肠。血液携带着氧气和营养物质流经肝动脉和门静脉进入肝脏,并通过肝静脉和下腔静脉流出,留下一些循环物质,这些物质可以通过有孔的血管内皮转移到Disse腔中,从而穿过肝细胞。最后,这些物质从胆小管汇聚到胆管中排泄。这些消除的物质包括MW 290-1300 Da的药物、IgA和我们先前报道的类胰岛素生长因子。所以研究人员想知道是否可以通过从血液排入小肠的方式清除这些致病生物危害(病毒、炎性因子、脂肪等)。因此,可以用这种方法治疗许多药物未得到满足的疾病,或者可以根除疾病的根本原因。
人工智能纳米材料可以在体内识别其靶标(酶、受体、细胞等)并选择性地结合它们。福州大学贾力教授团队证明,偶联在一起的双抗体或双适体可以在体内以高特异性捕获稀有循环肿瘤细胞(CTC),这是因为它们能够识别CTC上的两个生物标记并用双手抓住它们。药物可以结合循环的人血清白蛋白,并且结合改变其消除率。基于这些发现,贾力教授团队假设可以对适当的安全生物材料进行功能化,以特异性结合血液中不需要的生物危害,并通过Oddi括约肌将其提取到小肠中。循环致癌外泌体的大小和生物膜特性使它们成为检验该假设的理想模型材料。
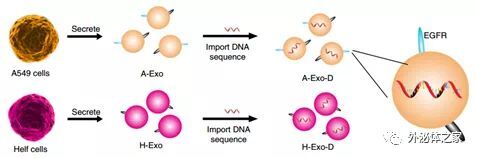
外泌体是由所有细胞产生和释放的细胞外囊泡。纳米大小的细胞外囊泡(40–150 nm)自然存在于血液中,并参与细胞间的通讯。它们的大小和脂质双层膜有助于它们有效进入其他细胞。致癌外泌体在特定器官部位定居,并通过其整合素介导的与器官特异性驻留细胞融合而开始转移前的生态位形成。外泌体的表面富含各种表面生物标志物,包括来自原始细胞的四跨膜蛋白(CD9、CD63、CD81和CD82)和表皮生长因子受体(EGFR、ErbB-1、HER1)。EGFR是一种重要的跨膜蛋白,可通过其胞外域与其特异性配体结合而激活。介孔二氧化硅纳米颗粒(Mesoporous silica nanoparticles, MSNs)是一种相对安全的生物材料,可以被肝脏迅速吸收,并迅速从肝脏排入胃肠道(gastrointestinal, GI)。MSN满足最低要求,即候选物质起着拖拉机的作用,将结合的外泌体从循环系统中拖入胃肠道。这项研究用靶向EGFR的适体对MSN进行了化学功能化(MSN-AP),以鉴定和结合源自表达高水平EGFR的人肺癌细胞A549的外泌体(A-Exo)。MSN-AP和A-Exo之间的分子间结合力(包括识别力和电荷力)使A-Exo的肝胆消除成为可能。此处介绍的创新概念和生物技术方法为将有害的循环物质“排泄”入小肠开辟了一条途径。
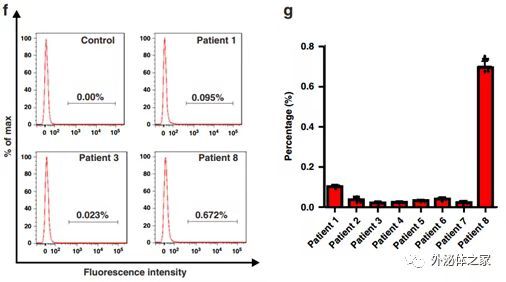
此外,为了进一步测试MSN-AP(用Cy-5标记)结合人癌症外泌体的特异性,在医院伦理委员会批准后,该研究向8例肺癌患者的血液样本中添加了MSN-AP(终浓度为40 µg/mL),并在样品孵育/离心过程后使用流式细胞仪检测了MSN-AP结合的外泌体。基于Cy5荧光信号,通过流式细胞术在患者血液中鉴定并定量了MSN-AP结合的EGFR外泌体。每个样品分为3-5个部分进行重复测量。EGFR阳性外泌体的数量似乎与患者的癌症分期密切相关。例如,晚期患者8与II期患者相比,其外泌体水平明显更高。
总之,该研究展示了一种经过智能设计的安全生物材料,可以从血液中准确识别、拖曳和倾倒有针对性的生物危害物到小肠中。用EGFR靶向适体(MSN-AP)功能化的带正电的介孔二氧化硅纳米颗粒(MSNs)特异性识别并结合血源性带负电荷的致癌性外泌体(A-Exo),并将A-Exo跨肝胆管层和Oddi括约肌牵引至小肠。 MSN-AP可从与细胞培养物中以及大鼠和患者血液中的干扰外泌体中特异性区分并结合A-Exo,从而通过内吞作用和胞吐作用机制形成横穿肝细胞、胆管细胞和内皮单层的MSN-AP和A-Exo连接物(MSN-Exo),尽管已经证明Kupffer细胞吞噬了某些MSN-Exo。血液MSN-AP显著降低了小鼠的循环A-Exo水平,随后增加了肠道A-Exo并减弱了A-Exo诱导的肺转移。这项研究为将血源性威胁生命的生物危害转移至肠道开辟了一条创新途径。
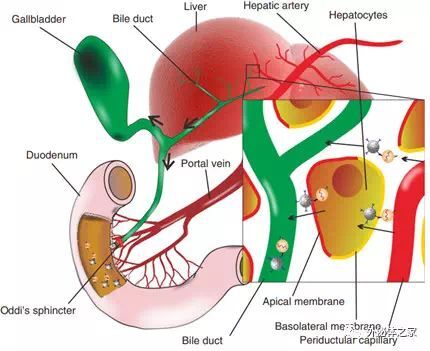
示意图显示MSN-AP与肝脏中循环的外泌体结合并拖曳到Disse空间中,并且缀合的MSN-Exo可以被极化的肝细胞吞噬,通过肝细胞进行穿胞运输并通过胆囊的Oddi括约肌进入胆管和小肠。
XiaodongXie, Huifang Nie, Yu Zhou, Shu Lian, Hao Mei, Yusheng Lu, Haiyan Dong, FengqiaoLi, Tao Li, Bifei Li, Jie Wang, Min Lin, Chaihung Wang, Jingwei Shao, Yu Gao,Jianming Chen, Fangwei Xie & Lee Jia. Eliminating blood oncogenic exosomesinto the small intestine with aptamer-functionalized nanoparticles. Nature Communications volume 10, Article number: 5476 (2019)