
血液中的物质通常通过两种途径从全身循环中清除:(1)肾脏滤过,排泄到尿液中;(2)肝胆清除,通过Oddi括约肌进入小肠。小于6nm的物质通常通过肾小球滤过而被清除。不能被Kuffer细胞立即捕获的较大物质通常通过肝胆清除进入小肠而被清除。
外泌体是由所有细胞产生和释放的细胞外囊泡。纳米尺寸的细胞外囊泡(40–150 nm)自然存在于血液中,并参与细胞间的通讯。其大小和双层脂质膜有助于它们有效进入其他细胞。致癌外泌体在特定器官部位定植,并通过整合素介导其与器官特异性常驻细胞的融合,启动转移前生态位的形成。外泌体的表面富含各种表面生物标志物,包括来自原始细胞的四跨膜蛋白(CD9,CD63,CD81和CD82)和表皮生长因子受体(EGFR;或ErbB-1;HER1)。EGFR是一种重要的跨膜蛋白,可通过其胞外域与其特异性配体结合而激活。
人工智能纳米材料可以在体内识别其靶标(酶,受体,细胞等)并选择性地结合它们。贾力教授团队研究人员在早先的研究已证明了,偶联在一起的双抗体或双适体可以在体内以高特异性捕获稀有循环肿瘤细胞(CTC),这是因为它们能够通过识别、结合CTC上的两个生物标记物来抓住CTC。
有鉴于此,福州大学贾力教授团队利用中空介孔二氧化硅纳米粒子(MSNs)作为拖拉机,将结合的外泌体从循环系统中拖入胃肠道。即:用EGFR靶向适配体功能化的带正电的介孔二氧化硅纳米粒子(MSN-AP)特异性识别并结合血源性带负电荷的致癌性外泌体(A-Exo),并将A-Exo穿过肝胆层和Oddi括约肌拖入小肠。实验结果显示,致癌性外泌体能诱导的A549 CTC向小鼠肺的器官性转移,同时能被MSN-AP治疗抑制。该创新概念和生物技术方法为将有害的循环生物危害物排泄入小肠开辟了一条途径。
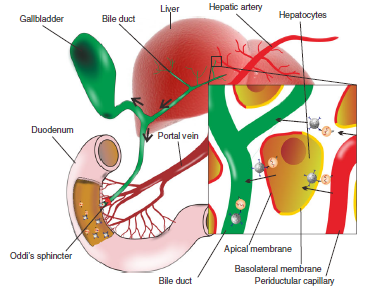
示意图显示MSN-AP与肝脏中循环的外泌体结合,并拖曳其到Disse空隙中,并且结合的MSN-Exo可以被极化的肝细胞吞噬,通过肝细胞进行穿胞运输,并通过胆囊的Oddi括约肌进入小肠。
福州大学肿瘤转移预警和预防研究所贾力教授为该论文通讯作者,博士生解晓东和聂慧芳为共同第一作者。本研究得到了国家科技部重大科学研究项目 (2015CB931804),国家基金委自然科学基金项目 (81773063; U1505225; 21907014; 81273548; 81571802; 81703555), 福建省科技厅自然科学基金项目(2016J06020)和中国博士后基金项目(2017M620268)经费资助与支持。
参考文献
XiaodongXie, Huifang Nie, Yu Zhou, Shu Lian, Hao Mei, Yusheng Lu, Haiyan Dong, FengqiaoLi, Tao Li, Bifei Li, Jie Wang, Min Lin, Chaihung Wang, Jingwei Shao, Yu Gao,Jianming Chen, Fangwei Xie & Lee Jia. Eliminating blood oncogenic exosomesinto the small intestine with aptamer-functionalized nanoparticles. Nature Communications volume 10, Article number: 5476 (2019)