近日,我院卢春华/杨黄浩课题组在Journal of the American Chemical Society上在线发表了题为“DNA Tetrahedron-Driven Multivalent Proteolysis-Targeting Chimeras: Enhancing Protein Degradation Efficiency and Tumor Targeting”的研究论文。在本文中,研究团队开发了一种基于 DNA 四面体的多价蛋白水解靶向嵌合体(PROTACs,AS-TD2-PRO),相较传统二价 PROTACs 展现出更强蛋白降解潜力,为癌症治疗提供了新思路。

蛋白水解靶向嵌合体(PROTACs)是一种双功能分子,由目标蛋白结合配体、E3连接酶结合配体和连接子组成,能够同时招募目标蛋白和E3连接酶,标记目标蛋白进行泛素化后被蛋白酶体降解,在疾病治疗中展现出巨大的应用潜力。与传统抑制剂相比,PROTAC在催化活性、选择性、克服耐药性及靶点阻断等方面具有显著优势。然而,如何通过连接子设计和配体修饰构建多功能平台,以提高降解效率和抗肿瘤活性,仍是PROTACs开发面临的重大挑战。DNA四面体作为一种可编程且可修饰的纳米材料,能够精确组装、选择性识别分子并灵活调节分子间的距离,是理想的连接子。与传统的柔性PEG接头相比,基于双链DNA的刚性接头能有效保持稳定构象,减少脱靶效应。因此,研究人员利用DNA四面体开发了一种多价PROTAC(AS-TD2-PRO),通过连接肿瘤细胞靶向模块、E3泛素连接酶和目标蛋白模块,增强了肿瘤特异性靶向性和降解效率。以不可成药的靶蛋白—信号转导及转录激活因子3(STAT3)为例,AS-TD2-PRO在小鼠肿瘤模型中展现出卓越的治疗效果。这一研究为癌症治疗提供了前景广阔的策略。
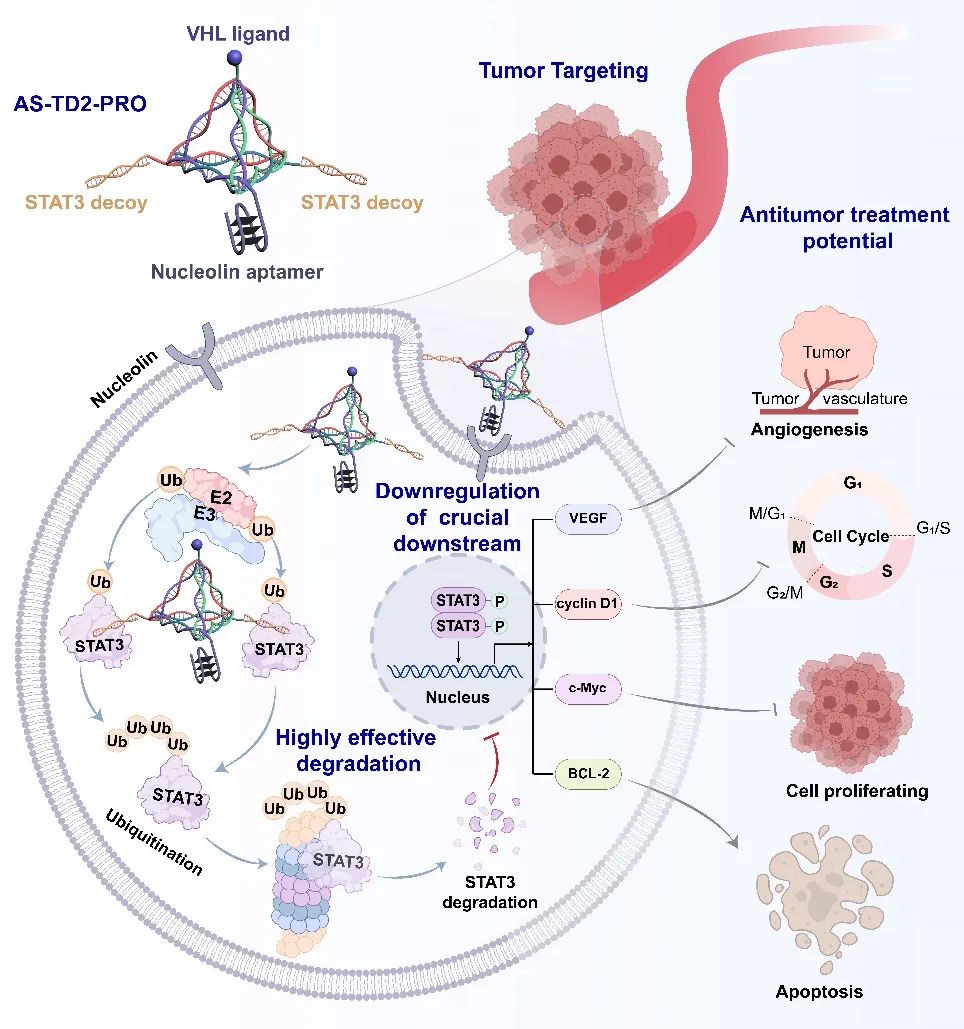
图 1 DNA四面体驱动的多价蛋白水解靶向嵌合策略示意图
这一成果发表在Journal of the American Chemical Society上,论文的第一作者为福州大学化学学院博士研究生李诗情和曾涛,福州大学的卢春华教授、杨黄浩教授为论文的共同通讯作者,为本研究提供了重要的指导。这项研究工作得到了国家重点研发计划、国家自然科学基金的大力支持。
论文信息
“DNA Tetrahedron-Driven Multivalent Proteolysis-Targeting Chimeras: Enhancing Protein Degradation Efficiency and Tumor Targeting”, Shiqing Li, Tao Zeng, Zhixing Wu, Jiabao Huang, Xiuping Cao, Yana Liu, Shiyan Bai, Qi Chen, Chunsen Li, Chunhua Lu, and Huanghao Yang. Journal of the American Chemical Society, 2025: DOI: 10.1021/jacs.4c16438