近日,我院宋秋玲教授课题组在国际权威期刊《J. Am. Chem. Soc.》上发表题为“Ni-Catalyzed Enantioselective Arylboration of 1,3-Cyclohexadiene”的研究成果。该研究发展了一种新颖高效的镍催化体系,利用易得的芳基碘化物和双联频哪醇硼酸酯(B₂pin₂),实现了1,3-环己二烯的高区域、对映及非对映选择性芳基硼化反应,为合成具有重要应用价值的手性硼化1,4-顺式-环己烯衍生物提供了直接高效的路径。

多取代六元环结构多样,是药物设计与开发中的重要结构平台。许多具有显著生物活性的天然产物和药物分子均基于此类环系构建。通过在六元环骨架上引入不同取代基,可有效调控候选药物的理化性质、生物活性及代谢行为。此外,该类化合物在有机合成、材料科学和高分子化学等领域也具有重要价值。因此,发展高效、立体选择性构建多取代六元环的方法备受关注。值得注意的是,热力学上不稳定的1,4-顺式二取代环状结构通常具有独特的物理与生物活性,但其合成仍面临较大挑战。目前,针对这类能量不利异构体的立体选择性合成方法仍然有限,亟需开发直接、高效的合成策略。
1,3-环己二烯作为一种易得且稳定的合成砌块,可通过直接的1,4-双官能化反应高效构建多取代环己烯骨架。产物中保留的碳碳双键便于后续多样转化,进一步拓展合成应用。目前,钯催化的环己二烯双官能化反应虽能区域和非对映选择性地合成多取代环己烯,并可分别得到1,4-顺式与1,4-反式产物,但该方法依赖昂贵的钯催化剂,且难以实现高对映选择性控制,因此,开发新型不对称合成方法具有迫切需求。近年来,镍催化的1,3-二烯不对称多组分反应取得显著进展,为环状化合物的不对称官能化提供了理论指导。同时,有机硼酸酯可立体专一地转化为多种官能团,因此发展催化不对称合成硼化环己烯的方法,有望为获取多样取代的六元环体系提供通用平台。
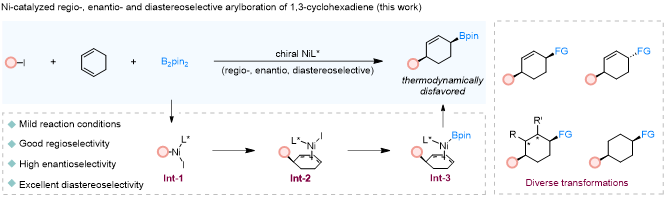
基于此,宋秋玲教授团队创新性地提出镍催化下1,3-环己二烯与芳基碘化物、B₂pin₂的不对称三组分芳基硼化反应。该策略利用廉价金属镍与易得手性配体,一步高效构建同时含硼酸酯基与碳碳双键的手性1,4-顺式-环己烯衍生物。温和的反应条件赋予该方法良好的官能团兼容性,并通过广泛的底物适用性、生物活性分子的后期修饰以及多样后续转化得到验证。特别值得指出的是,产物中的硼基与双键可作为“合成手柄”,用于高效构建含一个、两个甚至多个手性中心的重要六元环化合物,极大拓展了合成工具箱,为药物研发提供了结构新颖的候选分子。结合深入的机理研究,该工作为理解与设计此类不对称转化提供了重要理论依据。
福州大学宋秋玲教授为论文通讯作者,化学学院博士后李汪洋为第一作者,硕士研究生郑艳萍、顾运雅等在实验部分做出重要贡献。该研究获国家重点研发计划、国家自然科学基金、福建省自然科学基金,以及河南师范大学化学化工学院、南京大学配位化学国家重点实验室开放课题等项目资助。
论文信息:"Ni-Catalyzed Enantioselective Arylboration of 1,3-Cyclohexadiene", Wangyang Li, Yanping Zheng, Yunya Gu, Jinhui Xie, Yanying Huang, and Qiuling Song*, J. Am. Chem. Soc. 2025, DOI: 10.1021/jacs.5c14738.