近日,我院李兴淑教授团队最新研究成果以“De Novo Construction of Glutathione Activatable Photosensitizers Boosts Sequential Photoacoustic and Fluorescence Imaging and Precise Photodynamic Therapy”为题发表在在国际知名学术期刊《Advanced Materials》。

光动力治疗(PDT)已经在临床抗肿瘤上取得重要进展,然而,当前的PDT药物是“always-ON”的,接受PDT的患者不可避免地经历长时间的避光处理,以尽量减少“always-ON”PDT药物的有害光敏化反应。可激活型光敏剂(aPS)通过响应肿瘤微环境特异性刺激实现从“OFF”到“ON”的切换,是提高PDT精准度的有效策略。其中,基于亲核芳香取代反应(SNAr)、以2,4-二硝基苯磺酸酯为代表的谷胱甘肽(GSH)aPS尤为引人关注。然而,该类aPS普遍存在淬灭效率不足以及对生理浓度GSH过度敏感的问题,易在血液循环中被提前激活,导致诊断假阳性并损伤正常组织,严重制约其临床转化。
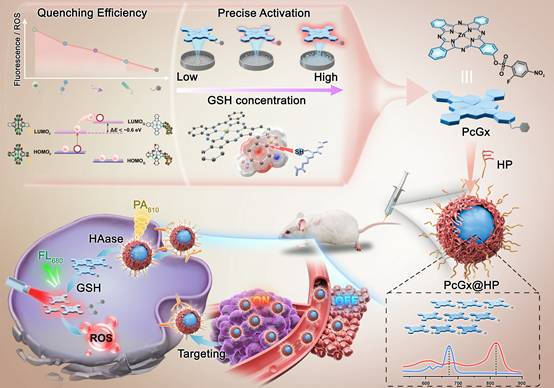
针对这些问题,李兴淑教授团队设计合成了一系列邻、对位基团不同的苯磺酸酯单取代的GSH可激活酞菁基光敏剂(PcGx),系统研究并探讨了淬灭基团上取代基(-R1, -R2)的吸电子能力对荧光量子产率(ΦF)与单线态氧量子产率(ΦΔ)的影响。经过针对15种不同取代基的酞菁光敏剂筛选后,PcG12与PcG13在保持对肿瘤细胞内毫摩尔级别GSH高响应性的同时,在微摩尔生理GSH浓度下保持“静默”,展现出优异的浓度选择激活特性。为进一步提升靶向递送效率和成像结果的可靠性,本研究引入两亲性载体HA-PBA(HP),构建了J聚集驱动的纳米平台PcGx@HP。该平台不仅通过J聚集将纳米体系的吸收峰红移至820 nm,还主动靶向肿瘤细胞膜表面过表达的CD44受体。共聚焦成像结果表明,PcG12和PcG13在GSH高表达细胞系(A549,4T1)中能显著恢复荧光,而在正常细胞(HELF,L929)中信号微弱。在体内实验中,PcG12@HP展现出卓越的顺序性成像能力。针对4T1皮下肿瘤模型小鼠静脉注射PcG12@HP后,纳米颗粒首先在肿瘤部位富集,凭借其J聚集特性在810 nm处产生强烈的光声信号。随后,肿瘤微环境中的透明质酸酶引发纳米体系崩解,释放出的PcG12被肿瘤细胞内高浓度GSH激活,恢复其680 nm处的近红外荧光信号。这种“先光声后荧光”的顺序性成像模式,实现了对实体肿瘤的双重验证,极大提高了诊断精度。不仅如此,PcG12@HP介导的PDT治疗显示出强大的抗肿瘤功效,且未引发明显的系统毒性或脱靶损伤。组织学分析与肝肾功能检测进一步证实了其良好的生物安全性。综上所述,本研究通过对传统淬灭基团的解构与纳米工程化策略,成功构建了一种兼具高淬灭效率、精准GSH浓度响应、主动肿瘤靶向及顺序性多模态成像能力和精准PDT的新型纳米光诊疗平台。
福州大学化学学院李兴淑教授为论文的唯一通讯作者,福州大学化学学院在读博士生傅树文和硕士生黄泊宁,以及已毕业硕士生文煌为论文的共同第一作者。该研究得到了国家自然科学基金、国家重点研发计划等经费的资助。文章链接:https://doi.org/10.1002/adma.202509641.