2024年6月17日,我院林忠辉教授团队在金属离子催化Holliday junction解离的分子机制研究上取得重要进展,相关研究成果以“MOC1 cleaves Holliday junctions through a cooperative nick and counter-nick mechanism mediated by metal ions”为题发表在《自然通讯》杂志上。

Holliday junction(HJ)是英国分子生物学家Robin Holliday于1964年首次发现,是在DNA同源重组损伤修复过程中形成的一种十字叉状的DNA连接体,在噬菌体、细菌、真菌、植物乃至动物细胞中均存在。在同源重组后期,HJ必须在HJ解离酶的作用下解离成为两条线性DNA,从而确保生物体基因组的多样性和稳定性 [1]。
MOC1(monokaryotic chloroplast 1)是一个叶绿体特异的HJ解离酶[2],在进化上来源于细菌RuvC蛋白。林忠辉教授团队于2019年通过解析MOC1与HJ DNA的复合物晶体结构揭示了MOC1识别底物的结构特异性和序列特异性的分子机理(Nat. Chem. Biol., 2019)[3]。然而,由于这些ES复合物结构是在非反应条件下获得的,包括引入活性中心关键催化残基的突变或加入不具催化活性的金属离子如Ca2+,因此,有关HJ DNA解离过程中的金属离子催化机制仍然不明确。
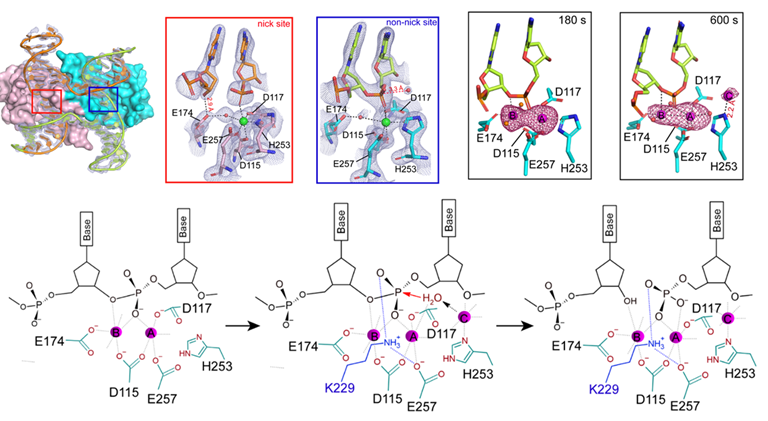
时间分辨晶体学技术揭示MOC1在Mn2+离子催化下切割HJ的工作机制(摘自Zhang et al. Nat. Commun.,2024)
在这项研究中,林忠辉教授研究团队通过时间分辨晶体学技术,还原了MOC1切割HJ DNA的催化过程,发现HJ的解离需要三个金属离子的共同参与,并揭示了金属离子介导的别构调节对于HJ的高效且精准解离中的关键作用。这一发现为我们深入理解细胞如何在同源重组过程中确保基因组的稳定性与完整性,提供了新的视角和实验依据。
HJ DNA的解离过程依赖于HJ解离酶在其独特的十字叉中心对称的两个位点上进行精确的切割。研究团队首先通过一系列的生化实验证实,MOC1同源二聚体对于HJ DNA上其中一个位点的切割会显著加速其在另一个位点的剪切效率。反之,若首次切割发生在非正确的位点,则会严重阻碍第二个位点的切割进程。这种机制对于确保HJ的高效且精准解离至关重要。为了进一步揭示这一机制的分子基础,研究团队首先解析了MOC1与含单一切割位点HJ DNA的复合物晶体结构。以此结构为基态,研究团队利用时间分辨晶体学技术,将此复合物晶体在Mn2+离子中浸泡一系列时间,从而成功地捕获到了多个不同的催化状态,包括单一金属离子和双金属离子结合状态。更为重要的是,研究团队意外地发现,HJ的解离还需要第三个金属离子的参与,该金属离子可能在水分子对磷酸酯的亲核攻击过程中发挥关键作用。最后,研究团队结合一系列的结构和生化数据提出,在以同源二聚体形式发挥作用的HJ解离酶中,其两个催化中心并非孤立存在的,它们之间通过金属离子的配位以及HJ构象的动态变化紧密相连,这种相互作用确保了HJ解离过程的高效性和精确性。
在上述工作中,我院林忠辉教授和苏州大学罗智璞教授为共同通讯作者,我院2020级博士生张丹萍同学为第一作者。该研究得到了国家高层次青年人才计划、国家自然科学基金、福建省百人计划和福建省高校领军人才等专项经费的资助。上海同步辐射光源(SSRF)为本研究提供了重要的技术支持。
原文链接
https://www.nature.com/articles/s41467-024-49490-9
参考文献
[1] Lilley, D.M. & White, M.F. The junction-resolving enzymes. Nat Rev Mol Cell Biol 2, 433-443 (2001).
[2] Kobayashi Y, Misumi O, Odahara M, Ishibashi K, Hirono M, Hidaka K, Endo M, Sugiyama H, Iwasaki H, Kuroiwa T, Shikanai T, Nishimura Y. Holliday junction resolvases mediate chloroplast nucleoid segregation. Science. 2017, 356(6338):631-634.
Lin H, Zhang D, Zuo K, Yuan C, Li J, Huang M, Lin Z. Structural basis of sequence-specific Holliday junction cleavage by MOC1. Nat Chem Biol. 2019, 15:1241-1248.