最近,我院杨黄浩教授课题组在纳米医学和纳米诊断治疗学研究方向取得重要进展,相关成果发表在Adv. Mater.、J. Am. Chem. Soc.上。
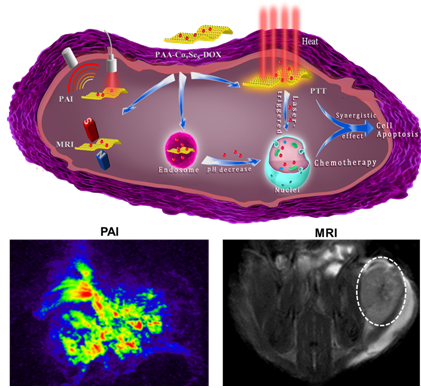
近年来发展起来的诊疗一体化纳米探针不仅可以实现肿瘤的成像和治疗,而且可以实时跟踪治疗效果。近日,杨黄浩教授课题组与厦门大学刘刚教授课题组合作,成功制备了硒化钴纳米盘材料。该硒化钴纳米盘的生物毒性低,且具有近红外光吸收和缩短核磁共振横向弛豫时间的性能。通过细胞和小鼠实验证明了该纳米材料可以用做肿瘤的光声和核磁共振双模态成像造影剂,并且也可用做光热治疗试剂,在近红外光照射下实现对肿瘤的光热杀伤。同时,由于硒化钴纳米盘的高比表面积,也可以吸附抗癌药物形成药物纳米材料复合物,该复合物显示了对肿瘤酸性环境响应的药物释放性能。通过多模态成像定位后,对小鼠局部位置进行光照,可实现肿瘤的光热和化学联合治疗以达到最佳治疗效果。该新型诊疗纳米试剂的制备方法简单,不仅可以大大提高肿瘤的治疗效果又降低了副作用。该工作也将拓宽二维纳米材料的生物医学应用。该工作以“Co9Se8 Nanoplates as a New Theranostic Platform for Photoacoustic/Magnetic Resonance Dual-Modal Imaging Guided Chemo-Photothermal Combination Therapy”为题发表于Adv. Mater. http://onlinelibrary.wiley.com/doi/10.1002/adma.201405634/full。
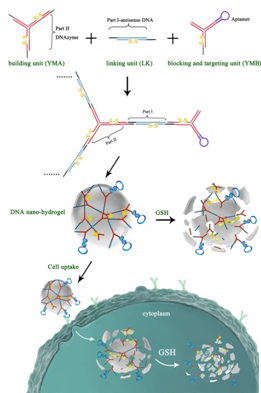
杨黄浩教授课题组与美国佛罗里达大学谭蔚泓教授课题组合作,成功制备了刺激响应的DNA纳米水凝胶,实现肿瘤靶向性的活细胞荧光成像和基因治疗。通过设计了2种Y型单体:1种是组装单体AY,含有3个粘性末端;1种为阻止单体BY,仅含有一个粘性末端,同时含有癌细胞靶向的核酸适体。另应用具有和Y单体粘性末端互补的双链DNA作为交联剂LK,通过DNA组装,可形成纳米结构的水凝胶。更有趣的是,通过改变两种单体的比例能够形成不同大小的DNA水凝胶颗粒,颗粒大约为75 nm-240 nm。为实现基因治疗,在AY单体中设计含有DNAzyme基因,能够识别切割特异的mRNA;在交连DNA(LK)中设计含有反义基因;在非治疗基因序列中设计含有双硫键。而且,水凝胶纳米颗粒中含有核酸适体,具有很好的靶向性。因此,进入靶细胞后,该纳米水凝胶在细胞内GSH的作用下发生解体,释放治疗基因,达到基因治疗的目的。该工作以“Self-assembly of DNA Nanohydrogels with Controllable Size and Stimuli-Responsive Property for Targeted Gene Regulation Therapy”为题发表于J. Am. Chem. Soc., 2015, 137, 1412-1415.
杨黄浩教授课题组从2010年开始纳米医学和纳米诊断治疗学方向研究。已在Adv. Mater.、JACS、Angew、ACS Nano、NPG Asia Materials等刊物上发表系列论文。2014年,杨黄浩教授课题组与厦门大学刘刚教授课题组合作,利用一种原位自聚合的方法合成了Fe3O4@聚多巴胺核壳纳米复合物(Fe3O4@PDA NCs),用于细胞内mRNA检测及成像指导的光热治疗。聚多巴胺(PDA)能有效地吸附荧光标记的单链DNA探针并猝灭其荧光。当目标mRNA存在时,目标mRNA与PDA竞争结合DNA探针,导致DNA探针从PDA表面脱离,荧光恢复。因此,Fe3O4@PDA NCs可用于细胞内mRNA检测。而且,PDA还具有较强的近红外光吸收,可实现癌症的光声成像及光热治疗。另外,由于Fe3O4纳米粒子的磁性,该纳米复合物还可用于磁共振成像。相关工作发表在ACS Nano, 2014, 8, 3876-3883。
(杨黄浩课题组供稿)